Neue Medikamente: Von der Idee zur Zulassung
Vom ersten Laborversuch bis zur Apotheke vergehen in der Erforschung neuer Medikamente im Schnitt 13 Jahre. Der Grund: Jedes neue Mittel muss in mehreren Stufen sorgfältig geprüft werden, vor allem auf Wirksamkeit und Sicherheit. Fachleute aus den Bereichen Chemie, Biologie, Medizin und Pharmazie sind an diesem Prozess beteiligt.
Welche Schritte bis zur Zulassung nötig sind und was genau in dieser Zeit passiert, erfahren Sie in dieser Bildergalerie.

Neue Medikamente: Woran wird geforscht?
Am Anfang jedes neuen Medikamentes steht die Frage, bei welchen Krankheiten ein besonders großer Bedarf an neuen Therapien besteht. Häufig sind das Erkrankungen, die bislang nur schwer oder unzureichend behandelbar sind, etwa Krebserkrankungen, neurodegenerative Erkrankungen wie Alzheimer oder Autoimmunerkrankungen. Idealerweise soll das neu entwickelte Medikament wirksamer sein als bestehende Therapien und weniger Nebenwirkungen haben.
Lesetipp: KI in der Medizin – diese Krankheiten lassen sich früh erkennen

Neue Medikamente: Es beginnt im Labor
Ist ein solches Forschungsziel formuliert, beginnt die eigentliche wissenschaftliche Arbeit im Labor. Forschende untersuchen, welche biologischen Mechanismen bei einer Erkrankung eine zentrale Rolle spielen und sich grundsätzlich beeinflussen lassen. Dazu nutzen sie Zellkulturen und ausgewählte Testsubstanzen, um zu prüfen, ob ein Ansatz überhaupt einen Effekt zeigt. Viele Ideen erweisen sich bereits in dieser frühen Phase als ungeeignet.
Lesetipp: Klinische Studien – 10 Fakten, die Sie kennen sollten

Massentests im Labor: Die Suche nach einem Treffer
Anschließend beginnt die gezielte Suche nach passenden Wirkstoffen. In großen Laboren testen Forschende mithilfe von Robotern hunderttausende Substanzen aus umfangreichen Sammlungen darauf, ob sie den gewünschten Effekt zuverlässig auslösen. Nur sehr wenige zeigen dabei die gewünschte Wirkung. Diese Substanzen bilden die Ausgangsbasis für die weitere Forschung. Bis zu einem tatsächlich einsetzbaren Medikament ist jedoch noch ein weiter Weg.

Vom Treffer zum Wirkstoffkandidaten
Ein Treffer aus dem Massentest ist noch kein Medikament. Forschende verändern diese Substanzen gezielt, um ihre Wirkung, Verträglichkeit und Stabilität im Körper zu verbessern. Dieser Optimierungsprozess dauert oft mehrere Jahre. Wenige ausgewählte Substanzen gelten schließlich als Wirkstoffkandidaten und gehen in die präklinische Entwicklung.
Lesetipp: Endometriose-Diagnose per Speicheltest – Hoffnung für Betroffene?

Neue Medikamente: Tests vor dem Menschen
In der präklinischen Entwicklung werden die verbliebenen Wirkstoffkandidaten umfassend geprüft, bevor Tests am Menschen erlaubt sind. Untersuchungen erfolgen zunächst an Zellkulturen, später auch in Tierversuchen, die teilweise gesetzlich vorgeschrieben sind. Geprüft wird vor allem, wie gut die Substanzen vertragen werden und ob schädliche Wirkungen auftreten. Nur Kandidaten, die diese Tests bestehen, dürfen in klinischen Studien weiterentwickelt werden.
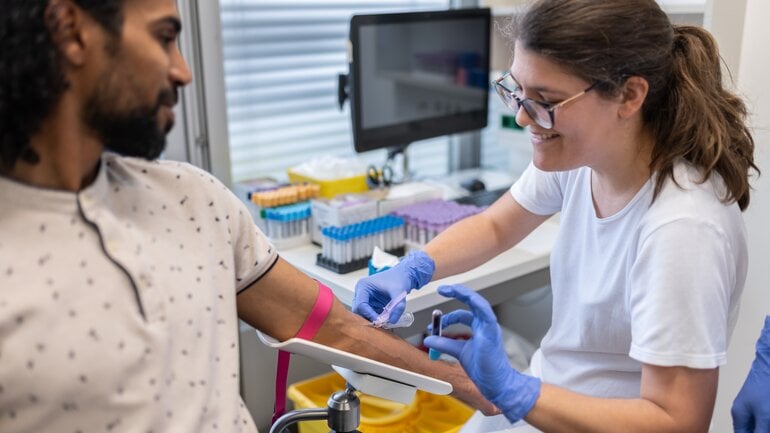
Phase-I-Studien: Erste Tests am Menschen
In Phase I wird der Wirkstoffkandidat erstmals an gesunden Freiwilligen getestet. Dabei geht es nicht um die Wirksamkeit, sondern um Sicherheit, Verträglichkeit und darum, wie der Stoff im menschlichen Körper aufgenommen, verteilt und abgebaut wird. Parallel wird die geeignete Darreichungsform entwickelt, etwa als Tablette, Kapsel oder Injektion, damit der Wirkstoff später zuverlässig an seinen Wirkort gelangt.
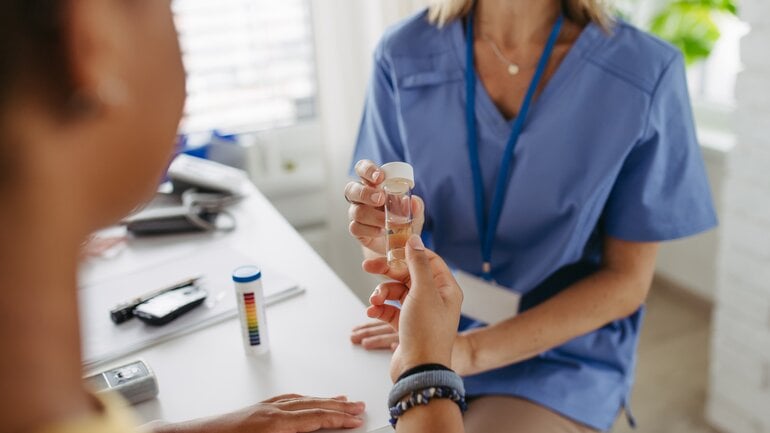
Phase-II-Studien: Wirksamkeit und richtige Dosierung
In Phase II wird das Medikament erstmals an Patient*innen mit der entsprechenden Erkrankung getestet. Ziel ist es, zu prüfen, ob sich der gewünschte Behandlungseffekt zeigt und welche Dosierung am besten geeignet ist. Gleichzeitig werden mögliche Nebenwirkungen weiter beobachtet. An diesen Studien nehmen meist einige hundert Betroffene teil.
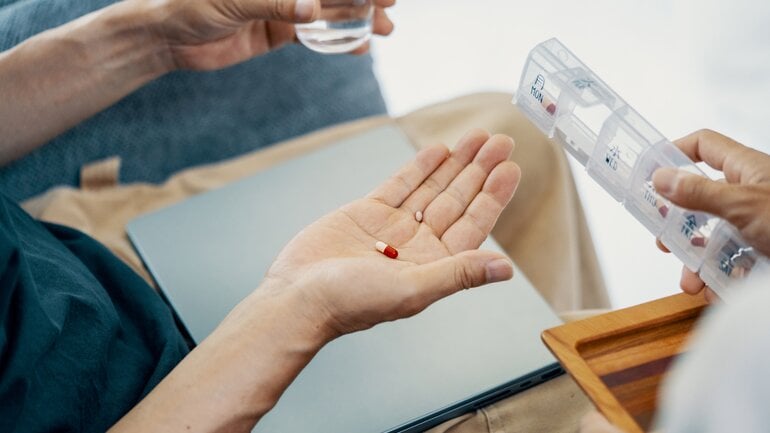
Phase-III-Studien
In Phase III wird das Medikament an tausenden Patient*innen erprobt. Forschende vergleichen dabei unterschiedliche Behandlungsgruppen, etwa das neue Medikament mit einer Standardtherapie oder einem Placebo. Die Patientengruppen werden zufällig eingeteilt und weder Teilnehmende noch die behandelnden Ärzt*innen wissen, wer das neue Medikament erhält. Dabei zeigt sich, ob Wirksamkeit und Sicherheit des neuen Medikaments auch im breiten Einsatz überzeugen.

Zulassung neuer Medikamente
Nach Abschluss der Phase-III-Studien werden alle Ergebnisse bei den zuständigen Behörden eingereicht. Fachleute prüfen, ob das neue Medikament wirksam ist und ob sein Nutzen mögliche Risiken überwiegt. Erst wenn diese Prüfung positiv ausfällt, wird das Arzneimittel zugelassen. In Europa sind dafür unter anderem die Europäische Arzneimittel-Agentur (EMA) oder nationale Behörden zuständig. Danach kann die Produktion des Medikaments in größerem Maßstab starten. Es kann von Ärzt*innen verschrieben und in Apotheken verkauft werden.
Lesetipp: Wie entsteht Krebs?

Phase IV: Beobachtung im Alltag
Auch nach der Zulassung wird ein neues Medikament weiter überwacht. Ärzt*innen dokumentieren Erfahrungen aus dem Behandlungsalltag, um sehr seltene Nebenwirkungen, Wechselwirkungen mit anderen Medikamenten oder Langzeiteffekte zu erkennen. Diese sogenannte Phase IV trägt dazu bei, die Sicherheit der Therapie langfristig zu verbessern.
Vom ersten Laborversuch bis zur Apotheke vergehen in der Erforschung neuer Medikamente im Schnitt 13 Jahre. Der Grund: Jedes neue Mittel muss in mehreren Stufen sorgfältig geprüft werden, vor allem auf Wirksamkeit und Sicherheit. Fachleute aus den Bereichen Chemie, Biologie, Medizin und Pharmazie sind an diesem Prozess beteiligt.
Welche Schritte bis zur Zulassung nötig sind und was genau in dieser Zeit passiert, erfahren Sie in dieser Bildergalerie.
- Online-Informationen des Verbandes Forschender Arzneimittelhersteller e.V.: So entsteht ein neues Medikament: https://www.vfa.de/de/forschung-entwicklung/pharmaforschung/so-entsteht-ein-medikament.html (Abruf: 01/2026)
- Online-Informationen von: Arzneimittelentwicklung: DocCheck Community GmbH: https://flexikon.doccheck.com/de/Arzneimittelentwicklung (Abruf: 01/2026)























